
- 药品简介
信迪利单抗注射液(商品名:达伯舒®),2018年12月24日国家药品监督管理总局批准上市,该药物的获批上市,标志着抗肿瘤免疫治疗进入了“中国创新时代”。2019年11月,信迪利单抗注射液成为唯一列名国家医保目录的PD-1单抗。 2019年2月22日,达伯舒正式在中国内地上市。
在第二十二届中国专利奖评审中,信达生物PD-1抗体专利荣获中国专利金奖。达伯舒是具有国际品质的创新PD-1抑制剂,拥有全球知识产权,体现了中国创新药在肿瘤免疫治疗领域的贡献。
达伯舒已在中国获批七项适应症,分别是:用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤 ;]联合培美曲塞和铂类化疗用于 EGFR 或 ALK 阴性的晚期非鳞状 NSCLC 的一线治疗;联合吉西他滨和铂类化疗适用于不可手术切除的局部晚期或转移性鳞状 NSCLC 的一线治疗;联合达攸同(贝伐珠单抗注射液)用于肝细胞癌的一线治疗; 联合化疗用于食管鳞癌的一线治疗; 联合化疗用于胃及胃食管交界处腺癌的一线治疗;联合贝伐珠单抗、培美曲塞和顺铂,用于经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗失败的EGFR基因突变阳性的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的治疗。七项适应症均纳入国家医保,成为唯一在五大高发瘤种一线治疗均获批的PD-1抑制剂。是唯一获批胃癌医保的PD-1免疫治疗药物。
【剂型】
注射剂
【药品类型】
生物制品
【生产厂】商信达生物制药(苏州)有限公司
【发展历程】
2024年2月22日,信达生物制药集团宣布,创新药物PD-1抑制剂达伯舒®(信迪利单抗注射液)正式获得中国澳门药物监督管理局(ISAF)批准上市。
【成份】
活性成份:信迪利单抗(重组全人源抗程序性死亡受体1单克隆抗体)。
本品中的辅料组成如下:甘露醇、组氨酸、枸橼酸钠(二水)、氯化钠、依地酸二钠、聚山梨酯80、枸橼酸(一水)、注射用水。
【性状】
本品为澄明至微乳光,无色至淡黄色液体,无异物。
【主要特点】
达伯舒具有高亲和力、持久稳定、靶点占位率高的特点,采用该药免疫治疗复发难治性霍奇金淋巴瘤的客观缓解率和疾病控制率均不亚于国际同类创新药物。
【适应症】
复发或难治性经典型霍奇金淋巴瘤/一线非鳞状非小细胞肺癌/晚期鳞状非小细胞肺癌的一线治疗/一线肝细胞癌/非鳞非小细胞肺癌/鳞状非小细胞肺癌/不可切除或转移性肝癌/胃癌 /食管癌
1、本品适用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗。
2、信迪利单抗注射液联合培美曲塞和铂类化疗,可用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的非鳞状非小细胞肺癌的一线治疗。
3、达伯舒获得国家药品监督管理局的批准,联合化疗应用于晚期鳞状非小细胞肺癌的一线治疗。
4、达伯舒®(信迪利单抗注射液)联合达攸同®(贝伐珠单抗注射液)用于既往未接受过系统治疗的不可切除或转移性肝细胞癌的一线治疗。
5、达伯舒获得国家药品监督管理局(NMPA)批准,联合含氟尿嘧啶类和铂类药物化疗,用于不可切除的局部晚期、复发或转移性胃及胃食管交界处腺癌的一线治疗。
6、达伯舒在原医保基础上,纳入了一线胃腺癌和一线食管鳞癌两项新适应症。
7、达伯舒联合贝伐珠单抗、培美曲塞和顺铂,用于经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗失败的EGFR基因突变阳性的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的治疗。
【规格】
10ml:100mg
【作用机制】
信迪利单抗注射液为信达生物自主研发的重组全人源免疫球蛋白G(IgG4)型抗程序性死亡受体-1(Programmed Cell Death 1,PD-1)单克隆抗体,通过结合PD-1并阻断PD-1与PD-L1和PD-L2的结合,解除免疫抑制效应,激活T细胞功能,增强T细胞对肿瘤的免疫监视能力和杀伤能力,产生肿瘤免疫应答。 [2]PD1药物通过激活人体自身的免疫系统,发现并攻击癌细胞,是继化疗、放疗之后的抗癌治疗方式,属于广谱性药物,一个药物可治疗多种癌症。
【公益基金】
2019年8月24日,由中国癌症基金会发起,信达生物制药支持的“达伯舒卫生扶贫公益项目”在苏州正式启动。项目将为全国低保和建档立卡的复发或难治性经典型霍奇金淋巴瘤患者免费提供2年的达伯舒(信迪利单抗注射液)药品援助,帮助患者治疗疾病、减轻经济负担,助力卫生健康扶贫工作。 [14]所捐赠的药品价值累计数亿元,超过15万名肿瘤患者免费用药近两年。
【所获荣誉】
信达生物PD-1抗体专利荣获中国专利金奖
重大新药创制专项
美国食品药品监督管理局(FDA)已受理中国自主研发创新生物药达伯舒的新药上市申请(BLA),并进入正式审评阶段。
达伯舒将海外市场成功转让给世界500强药企,是我国生物医药历史上最大的海外授权合作之一 ]
达伯舒®(信迪利单抗注射液)治疗淋巴癌关键研究结果荣登《柳叶刀》子刊血液病学封面 达伯舒(信迪利单抗注射液)联合达攸同 (贝伐珠单抗注射液)用于晚期肝癌一线治疗的随机、对照、开放多中心II/III期关键临床研究(ORIENT-32)结果刊登在国际知名期刊《柳叶刀·肿瘤学》上。
信迪利单抗注射液一线治疗胃癌达研究终点,共计5项适应症注册研究获阳性结果。
【药物相互作用】
本品是一种人源化单克隆抗体,尚未进行与其他药物药代动力学相互作用研究。因单克隆抗体不经细胞色素P450(CYP)酶或其他药物代谢酶代谢,因此,合并使用的药物对这些酶的抑制或诱导作用预期不会影响本品的药代动力学。
因可能干扰本品药效学活性,应避免在开始本品治疗前使用全身性皮质类固醇及其他免疫抑制剂。但是如果为了治疗免疫相关性不良反应,可在开始本品治疗后使用全身性皮质类固醇及其他免疫抑制剂(参见【注意事项】)。
【临床试验】
经典型霍奇金淋巴瘤
ORIENT-1(NCT03114683)研究为一项在既往接受过至少二线系统治疗的复发或难治性经典型霍奇金淋巴瘤患者中开展的开放性、多中心、单臂、II期临床试验,评估信迪利单抗单药的安全性和有效性。入组既往至少接受过二线治疗的复发或难治性经典型霍奇金淋巴瘤,至少有一个可测量病灶(病灶长径大于15 mm或者病灶长径在11mm~15mm但短径>10mm,FDG-PET扫描上病灶有摄取),所有患者需经中心病理确诊为经典型霍奇金淋巴瘤。本研究排除了美国东部肿瘤协作组体能状态(ECOG PS)评分>2、中枢神经系统淋巴瘤、自身免疫性疾病、间质性肺疾病、肝转氨酶>2.5×正常上限(ULN)、首剂研究治疗之前4周之内曾接受过全身性免疫抑制剂治疗、首剂研究治疗之前90天内接受过自体造血干细胞移植(ASCT)、首剂研究治疗之前3周之内接受最后一次放疗或最后一剂抗肿瘤治疗(化疗、靶向治疗或肿瘤栓塞术等)的患者。
患者接受信迪利单抗200mg静脉输注,每3周1次。最长治疗时间为24个月,研究治疗持续至疾病进展或出现不可耐受的毒性反应。肿瘤影像学采用增强CT和PET-CT。增强CT检查时间为基线期、第6/15/24周、24周后每12周和48周后每16周;PET-CT检查时间为基线期、第15周、提前终止研究药物治疗时或由研究者决定。
本研究共入组96例患者,全分析人群(FAS)定义为:基线有可测量病灶,经中心病理确诊且至少使用过一次研究药物的受试者人群,挽救化疗后接受自体干细胞移植之后复发或进展;对于未接受自体干细胞移植的受试者,则要求第一线化疗须为全身多药联合化疗,后续化疗要求至少有一线化疗为全身多药联合化疗。1)对于难治患者,指疗程≥2周期未达到PR,或者疗程≥4周期未达CR,如最佳疗效或治疗结束原因为PD,则疗程数不作要求;2)对于复发患者,复发前近期内至少接受过二线化疗。符合上述FAS定义的患者共75例。
FAS人群中,受试者既往接受中位化疗方案个数为3个(范围:2~8),既往化疗方案个数≥3个的占56.0%,21.3%接受过自体移植,54.7%接受过放疗,6.7%接受过维布妥昔治疗。中位年龄为33.3岁(范围:18.1~68.6岁),男性占58.3%,ECOG PS评分为0分、1分和2分的患者分别占45.8%、53.1%和1.0%。最常见的病理亚型为结节硬化型56.3%,临床分期以III、IV期为主,占78.1%。基线合并B症状的受试者占21.9%,最常见的疾病相关症状为发热13.5%,50例患者存在肺部或纵隔病灶,6例患者存在基线淋巴瘤骨髓浸润。
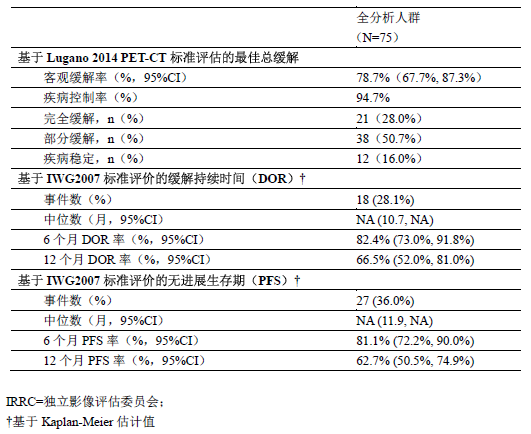
本研究的主要研究终点为客观缓解率(ORR),定义为最佳疗效为完全缓解和部分缓解的患者百分率,由独立影像评估委员会(IRRC)评价根据统一的Lugano 2014 PET-CT标准和以及方案定义的IWG 2007标准进行评价。次要有效性终点包括至缓解出现时间(TTR)、缓解持续时间(DOR)和无进展生存期(PFS)。
75例患者中位随访时间为14个月,最后1例入组受试者至少随访12个月。其关键有效性结果总结见表4。
表4. ORIENT-1研究由IRRC评估的关键有效性结果
【药理毒理】
药理作用
T细胞表达的PD-1受体与其配体PD-L1和PD-L2结合,可以抑制T细胞增殖和细胞因子生成。部分肿瘤细胞的PD-1配体上调,通过这个通路信号传导可抑制激活的T细胞对肿瘤的免疫监视。信迪利单抗是一种人类免疫球蛋白G4(IgG4)单克隆抗体(HuMAb),可与PD-1受体结合,阻断其与PD-L1和 PD-L2之间的相互作用,阻断PD-1 通路介导的免疫抑制反应,包括抗肿瘤免疫反应。在同源小鼠肿瘤模型中,阻断PD-1活性可抑制肿瘤生长。
毒理作用
生殖毒性
文献资料显示,PD-1/PD-L1通路的一个主要功能是维持妊娠母体对胎儿的免疫耐受。在妊娠小鼠模型中,阻断PD-L1信号通路会破坏母体对胎鼠的耐受性,增加胎鼠流产。兔胚胎-胎仔发育毒性试验中,信迪利单抗在给药剂量为200mg/kg(AUC约为临床推荐剂量下人体暴露量350倍)时出现胚胎毒性,引起吸收胎增加,妊娠率降低,未见致畸作用,对胚胎-胎仔毒性的NOAEL为40mg/kg( AUC约为临床推荐剂量下人体暴露量的65倍)。妊娠期间给予信迪利单抗有潜在的风险,包括流产或死胎的比例增加。基于信迪利单抗的作用机制,胎仔暴露于信迪利单抗可增加发生免疫介导紊乱或改变正常免疫应答的风险,在PD-1基因敲除小鼠中已有免疫介导紊乱的报道。
尚未开展信迪利单抗生育力试验。食蟹猴4周和26周重复给药毒性试验中,信迪利单抗对雄性和雌性生殖器官未见明显影响,对形态学上性成熟的雄性动物睾丸的正常精子生成、正常曲细精管相关细胞、精子生成各阶段的比例均未见明显影响。但研究中的部分动物尚未性成熟。
其他毒性
文献资料显示,在动物模型中抑制PD-1信号通路,可增加一些感染的严重程度和增强炎症反应。与野生型小鼠相比,感染结核分枝杆菌的PD-1基因敲除小鼠存活率明显降低,这与PD-1基因敲除小鼠体内细菌增殖和炎症反应增加有关。PD-1基因敲除小鼠感染脑膜炎病毒后存活率同样降低。
【药代动力学】
本品的药代动力学数据来自于2项临床研究,包括CIBI308A101研究和CIBI308B201研究。CIBI308A101研究评估了中国晚期恶性肿瘤患者使用4个剂量水平的信迪利单抗(1mg/kg、3mg/kg、10mg/kg每2周一次,200mg/次每3周一次,每个剂量N=3)的药代动力学,结果显示单次给予本品后,在1~10mg/kg的剂量范围内体内暴露(Cmax、AUC0-672h、AUC0-inf)随剂量增加而增加。CIBI308B201研究评估了中国复发或难治性经典型霍奇金淋巴瘤患者使用信迪利单抗(200 mg/次,每3周一次,N=13)的药代动力学,结果显示连续给药4周期后信迪利单抗的几何平均蓄积比为1.97倍。
吸收
本品采用静脉输注给药方式,血清浓度自输注开始逐渐上升,输注结束后达峰,之后缓慢降低。
分布
信迪利单抗在复发或难治性经典型霍奇金淋巴瘤患者中稳态分布容积(Vss)的几何均值(变异系数)为4.71 L(31.4%)。
消除
单次给药后,信迪利单抗在复发或难治性经典型霍奇金淋巴瘤患者中清除率的几何均值(变异系数)为9.98mL/h(50.1%)。消除半衰期的几何均值(变异系数)为13.7天(45.3%)。连续4周期给药后,信迪利单抗在复发或难治性经典型霍奇金淋巴瘤患者中的消除半衰期的几何均值(变异系数)为19.6天(23.7%)。
【贮藏】
将药瓶于2~8℃的冷藏环境下保存在原包装中,避光、避免冷冻、避免震荡。
【包装】
1瓶/盒。
【有效期】
24个月。
【批准文号】
国药准字S20180016
【市场信息】
据药融云数据显示,PD-1单抗达伯舒(信迪利单抗注射液)2020年全年销售收入超过22亿元人民币,第四季度超过7亿元人民币。
信息来源:百度百科