
- 药品简介
硼替佐米(万珂)属注射剂。硼替佐米是哺乳动物细胞中26S蛋白酶体糜蛋白酶样活性的可逆抑制剂。体外试验证明硼替佐米对多种类型的癌细胞具有细胞毒性。临床前肿瘤模型体内试验证明硼替佐米能够延迟包括多发性骨髓瘤在内的肿瘤生长。本品用于多发性骨髓瘤患者的治疗,有效性基于它的有效率。
【主要适用症】
多发性骨髓瘤患者
【适应症】
本品用于多发性骨髓瘤患者的治疗,此患者在使用本品前至少接受过两种治疗,并在最近—次治疗中病情还在进展。
本品的有效性基于它的有效率。尚无临床对照试验证明其临床利益,如对存活率的改善。
FDA批准的适应症:2003年,多发性骨髓瘤;2006年,套细胞淋巴瘤;2008年,多发性骨髓瘤的一线药物。
如果没有Velcade,千年制药公司可能还不会成为Takeda公司的子公司。Takeda公司在2008年支付88亿美元,购买千年制药公司与Velcade,用于替代当时上市的产品Actos和Prevacid,作为一枚投入药物市场的重磅炸弹。当年的晚些时候,Velcade就不负众望的完成了Takeda公司的预期。
在美国本土,Velcade的销售额继续以两位数的速度增长。2010年销售额达到5.8亿美金,超过2009年21%,2011年的6.927亿美金超过了2010年19%。这一药物今年或将迎来一个新的FDA批准,显然又会对其销售额的增长提供积极因素。
FDA批准Velcade可以进行皮下给药,这不仅使Velcade的吸收更为容易,也大大的提高了患者对Velcade的耐受性,减少了副作用。之前难以容忍Velcade的患者现在可以通过这种方式接受Velcade的治疗。千年制药集团CEODunsire指出,这一批准可能是在明年销售增长的原因之一。
【性 状】
本品为白色或类白色块状物或粉末
【主要成份】
硼替佐米,其化学名称为:[(1R)-3-甲基-1-[[(2S)-1-氧-3-苯基-2-[(吡嗪羧基)氨基]丙基]氨基]丁基]硼酸
【药理毒理】
●药效学
硼替佐米
硼替佐米是哺乳动物细胞中26S蛋白酶体糜蛋白酶样活性的可逆抑制剂。26S蛋白酶体是一种大的蛋白质复合体,可降解泛蛋白。泛蛋白酶体通道在调节特异蛋白在细胞内浓度中起到重要作用,以维持细胞内环境的稳定。蛋白水解会影响细胞内多级信号串联,这种对正常的细胞内环境的破坏会导致细胞的死亡。而对26S蛋白酶体的抑制可防止特异蛋白的水解。体外试验证明硼替佐米对多种类型的癌细胞具有细胞毒性。临床前肿瘤模型体内试验证明硼替佐米能够延迟包括多发性骨髓瘤在内的肿瘤生长。
●毒理学
尚未进行硼替佐米的致癌性研究。
用中国仓猝鼠卵巢细胞进行体外染色体畸变分析显示硼替佐米有诱裂活性(染色体结构畸变)。体外诱变性分析(埃姆斯试验)和小鼠体内小核分析结果显示硼替佐米没有基因毒性。
尚未对生育影响进行研究,但是在一般毒理学研究中对生殖组织进行了评价。6个月的大鼠毒理研究显示,剂量≥0.3mg/㎡(临床推荐剂量的1/4)时发现对卵巢有变性的作用,剂量为1.2mg/㎡时发现有变性的改变。本品可能对男性或女性的生育能力有潜在影响。
【药代动力学】
对8名多发性骨髓瘤患者静脉给予本品1.3mg/㎡,最大血药浓度中值为509ng/m1(范围109—1300ng/m1),肌酐清除率为3l—169ml/min。对晚期恶性肿瘤患者给予本品1.45—2.00mg/㎡,首剂量后的平均消除半衰期为9—15小时。作为单药,推荐剂量的硼替佐米在多发性骨髓瘤患者体内的药代动力学尚不完全明确。
●分布
尚未对推荐剂量的硼替佐米在多发性骨髓瘤患者体内的分布容积进行研究。浓度为100—1000ng/ml时,硼替佐米与人体血浆蛋白的平均结合率为83%。
●代谢
注射用硼替佐米(万珂)
利用人体肝微粒体和互补脱氧核糖核酸(cDNA)表达的细胞色素P450同工酶进行的体外研究显示,硼替佐米主要通过细胞色素P450酶系的3A4、2D6、2C19、2C9和IA2酶氧化代谢。主要代谢途径是去硼酸化,形成2个去硼酸化代谢物,再通过羟基化形成几个代谢产物。去硼酸化的硼替佐米代谢产物无抑制26S蛋白酶体的活性。8名患者给药后10—30分钟的血浆数据显示,血浆中代谢产物的浓度比原形药物低。
●消除
尚未对硼替佐米在人体内的消除途径进行研究。
●特殊人群
年龄、性别和人种:尚未就年龄、性别和人种对硼替佐米药代动力学影响进行评价。
肝功能损害的患者:尚未进行对肝功能损害患者的药代动力学研究。
肾功能损害的患者:尚未进行对肾功能损害患者的药代动力学研究。临床研究中患者的肌酐清除率为13.8—220m1/min。
儿童:尚无儿童药代动力学资料。
【临床研究】
对复发的或者难以治愈的多发性骨髓瘤的临床研究
为了评价本品的安全性和有效性进行了一个开放的、单臂、多中心临床研究,共有202名受试者,他们在使用本品前至少接受了两种治疗,并且证明在最近一次治疗中病情还在进展。先前治疗次数的中值为6。表2对患者入组时的基本情况和疾病特征进行了总结。
静脉给予本品,剂量为1.3mg/㎡,每周注射2次,连续注射2周后停药10天(即21天为1个疗程),最多持续8个疗程。研究中考虑到毒性,对剂量进行了调整。那些对本品的治疗显效的患者允许继续参加延续性试验。
表2:患者人群和疾病特征总结*
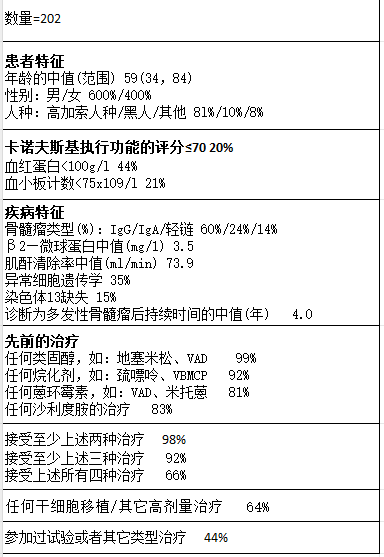
*基于有基本情况数值的患者人数。
对本晶单药治疗的疗效情况列于表3中。对本品的显效率由独立审评委员会根据B1扣e等人发表的标准确定。完全显效要求骨髓中浆细胞小于5%,M蛋白质100%减少,免疫固定检测(1F一)为阴性。表3中同时列出了使用SWOG标准判定的显效率。SWOG显效要求血清骨髓瘤蛋白减少≥75%和/或屎蛋白减少≥90%。对188名患者进行了疗效评价。9名患者因无法数据计量的疾病不能进行疗效评价。5名患者因有极低的前期治疗而被排除疗效评价。
98%的受试者接受了初始剂量1.3mg/m2。其中28%的受试者在整个试验中维持此剂量,但有33%的受试者在试验过程中降低了剂量。63%的受试者在研究过程中至少保持了一种剂量。通常,确认完全显效后,受试者再继续接受2个本品疗程。给药疗程的平均值为6。
起效时间中值为38天(范围30-127天)。
所有受试者存活时间中值为16月(范围1-18个月)。
表3:疾病结果总结

Kaplan-Merier显效持续
时间中值(95%C1) 365天 (224,NE)
1完全显效:婴求至少间隔6周进行!次免疫固定测定,血液和尿液总的原单克隆蛋白~.
100%i肖失:最少6周两次测定骨髓中浆细胞小干5%;钙和骨疾病稳定。
2部分显效:要求最少6周两次测定,血清骨髓赡蛋白减少≥50%和/或尿骨髓瘤蛋白减少≥90%;钙和骨疾病稳定。
3临床缓解(SWOG):要求最少6周两次测定,血清骨髓瘤蛋白减少≥75%和/或尿骨髓瘤蛋白减少≥90%:钙和骨疾病稳定。
在此研究中,对本晶的显效率与先前治疗的次数和类型无关。骨髓中浆细胞大干50%或者有细胞遗传学异常的患者存在显效下降的可能性。试验中观察到本品对染色体13异常的患者有效。
对54名多发性骨髓瘤患者进行的量效关系研究中,注射本品每次1.0mg/m2或1.3mg/m2,每周注射2次,连续2周,停药1周。两个剂量均观察到完全显效,总显效率(CR+PR)分别为30% (8/27)和38% (10/26)。
【规格】
每瓶含有3.5mg硼替佐米的无菌冻干粉末。
【贮藏】
在25℃(15~30℃)避光处保存。
【包装】
玻璃药瓶包装。1瓶/盒。
【有效期】
24个月
【进口注册证号】
H20050308
【分装批准文号】
国药准字J20050042
【生产企业】
美国Ben Venue Laboratories Inc 生产.
地址:Bedford,OH44146-0568 U.S.A.
【分装企业】
西安杨森制药有限公司
信息来源:百度百科