
- 药品简介
【成份】
本品主要成份为比卡鲁胺。
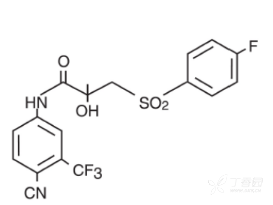
化学名称:(±)–N-[4-氰基-3-(三氟甲基)苯基]-3-[(4-氟苯基)磺酰基]-2- 羟基-2-甲基丙酰胺
化学结构式:

分子式:C18H14N2O4F4S
分子量:430.37
【规格】
50 mg;150mg
【适应症】
50 mg 每日:与促黄体生成素释放激素(LHRH)类似物或外科睾丸切除术联合应用于晚期前列腺癌的治疗。
150 mg 每日:用于治疗局部晚期、无远处转移的前列腺癌患者,这些患者不适宜或不愿接受外科去势术或其他内科治疗。
【药理作用】
比卡鲁胺属于非甾体类雄激素受体抑制剂,可通过与靶组织中的细胞质雄性激素受体结合,完全抑制雄性激素的作用。中和雄性激素和/或消除雄性激素来源可对雄性激素敏感的前列腺癌起治疗作用。
当比卡鲁胺与促黄体激素释放激素(LHRH)类似物联合治疗时,不会影响由 LHRH 类似物产生的对血清睾酮的抑制作用。在单独使用比卡鲁胺治疗前列腺癌的临床试验中,可观察到血清睾酮和雌二醇的升高。
在接受比卡鲁胺和 LHRH 类似物治疗,后因前列腺癌进展导致停用比卡鲁胺的亚组患者中,可能会引起前列腺特异性抗原(PSA)减少和/或抗雄性激素撤药性综合征。
【药代动力学】
吸收
本品经口服吸收良好。没有证据表明食物对其生物利用度方面存在任何临床相关的影响。
分布
本品与蛋白高度结合(消旋体 96%,(R)-对映体 > 99%)并被广泛代谢(经氧化及葡萄糖醛酸化),其代谢产物以几乎相同的比例经肾及胆消除。
生物转化
(S)-对映体相对(R)-对映体消除较为迅速,后者的血浆清除半衰期为一 周。
在本品的每日(50 mg 和 150 mg)用量下,(R)-对映体因其半衰期长,在血浆中蓄积了约 10 倍。
当每日服用本品 50 mg 时,(R)-对映体的稳态血浆浓度约 9 mg/ml,稳态时有效(R)-对映体占总循环内药量的 99%。
当每日服用本品 150 mg 时,(R)-对映体的稳态血浆浓度约为 22 mg/ml,在稳态时有效(R)-对映体占总循环内药量的 99%。
消除
接受本品治疗的男性患者精液中 R-比卡鲁胺均浓度为 4.9 mg/ml,通过性生活到达女性体内量低,约 0.3 mg/kg。动物试验表明此浓度不足以对子代产生影响。
特殊人群
(R)-对映体的药代动力学不受年龄、肾损害或轻、中度肝损害的影响。有证据表明在严重肝损害病例中,(R)-对映体血浆清除较慢。
【临床试验】
1. 50 mg 每日,与促黄体生成素释放激素(LHRH)类似物联合应用于晚期前列腺癌的治疗
在一项多中心、双盲、对照临床试验中,813 例既往未经治疗的晚期前列腺癌患者随机分配接受比卡鲁胺 50 mg,每天一次给药(404 例)或者氟他胺 250 mg,每天三次给药(409 例),两组均联合使用 LHRH 类似物(醋酸戈舍瑞林植入剂或醋酸亮丙瑞林长效制剂)。
在中位随访 160 周后进行分析,比卡鲁胺组 213 例(52.7%)和氟他胺组 235 例(57.5%)死亡。两组生存无显著差异(HR = 0.87,95%CI:0.72-1.05)。两组客观疾病进展时间也无显著差异(HR = 0.93,95%CI:0.79-1.10)。两组生活质量评估、治疗相关症状等也无明显差异。
2. 150 mg 每日单药用于治疗局部晚期、无远处转移的前列腺癌患者
在有 8113 名患者参加的三项安慰剂对照的双盲研究中,对本品 150 mg 用于治疗局限性(T1-T2,N0 或 NX,M0)或局部晚期(T3-T4,任何 N;或任何 T,N + )的非转移性前列腺癌(所有 M0)的研究结果进行了合并分析,在这些研究中本品被作为一线激素治疗或作为前列腺切除术或放疗后的辅助治疗。在 9.7 年的中位随访期时,以本品和安慰剂治疗的患者分别有 36.6%和 38.17%出现了客观疾病进展。
在多数患者组间均可观察到疾病进展风险的下降,但在那些疾病进展高风险的患者中特别明显,因此临床医生应该决定对于疾病进展低风险患者的最佳治疗方案,可能应将激素治疗延缓至出现疾病进展症状。
在 9.7 年中位随访中,未见总体生存的差异,死亡率为 31.4%(HR = 1.01;95%CI 为 0.94 至 1.09)。然而,对于一些接受本品作为单药治疗的亚组患者进行的探索性分析可见某些趋势:
与安慰剂组相比,接受本品单药治疗的局限性疾病患者,在无进展生存方面未显示出差异。对于接受比卡鲁胺作为放疗后辅助治疗的患者(HR = 0.98;95%CI 为 0.80 至 1.20),或是作为前列腺癌根治术后辅助治疗的患者(HR = 1.03;95%CI 为 0.85 至 1.25),也未显示出总生存的差异,而观察等待亚组有生存下降趋势(HR = 1.15;95%CI 为 1.00 至 1.32)。有鉴于此,认为使用本品的风险利益比对于局限性疾病患者并不有利。
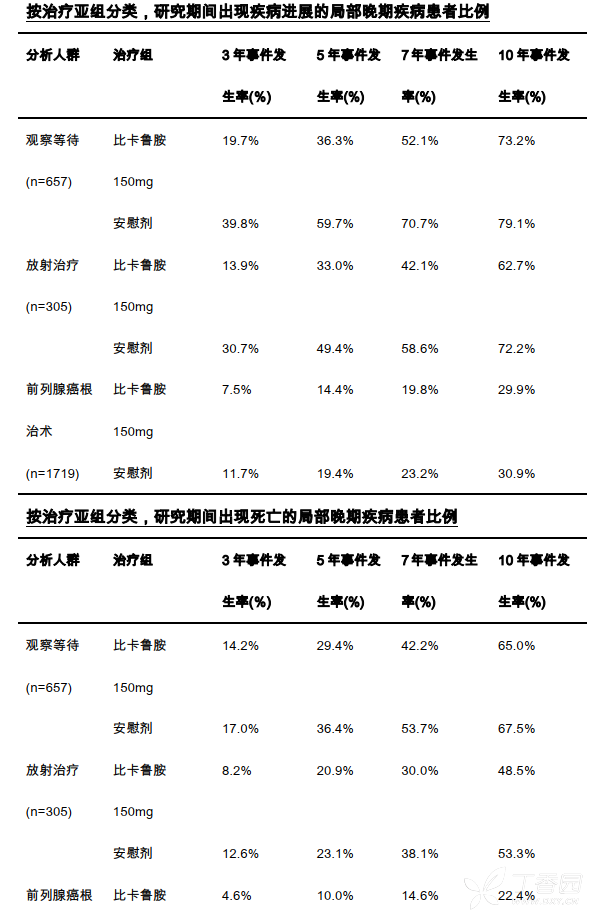
与安慰剂组相比,接受本品单药治疗的局部晚期观察等待亚组患者显示出生存改善的趋势(HR = 0.81;95%CI 为 0.66 至 1.01)。局部晚期前列腺癌患者无进展生存和总体生存数据可见下表:
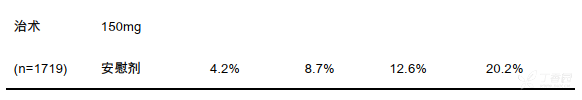
在另一研究项目中,通过对两项 480 名未经治疗的局部晚期非转移性(M0)前列腺癌患者参加的研究进行合并分析,证明了本品 150 mg 治疗局部晚期非转移性前列腺癌患者(这些患者被要求立即进行去势手术)的疗效。在 56%的死亡率和 6.3 年的中位随访期时,以本品治疗和去势手术相比在生存期方面没有显著性差异(HR = 1.05;CI 为 0.81 至 1.36),但统计学上尚不能认为两种治疗是等效的。
对两项 805 名未经治疗的转移性(M1)前列腺癌患者参加的研究进行合并分析,达到 43% 的死亡率时表明,在生存期指标上以本品 150 mg 治疗不如去势手术有效(HR = 1.30;CI 为 1.04 至 1.65),在 2 年的中位生存期内,预计两者达到死亡的时间差别为 42 天(6 周)。
在中国的注册临床试验为一项随机、开放、多中心研究,对 58 位前列腺癌 TNM 分期为 T3 或 T4,任何 N,M0 且 PSA ≥ 10 μg/L 的患者,评价比卡鲁胺 150 mg 单用与单独药物去势治疗比较疗效和安全性。结果显示比卡鲁胺 150 mg 单药治疗 12 周,其 PSA 的抑制率为 62.2%,前列腺体积缩小 36.3%;同目前的标准的去势治疗相比疗效相似。
同时,比卡鲁胺 150 mg 的总体安全性良好,治疗过程中无严重不良事件发生,没有受试者因不良事件而暂停和退出研究。2 例与药物相关的不良事件主要为乳房疼痛和男子乳腺发育。
【毒理研究】
遗传毒性
比卡鲁胺酵母基因突变试验、Ames 试验、CHO/HGPRT 基因突变试验、人淋巴细胞遗传学试验、小鼠微核试验、大鼠骨髓细胞遗传学试验结果为阴性。
生殖毒性
重复给药毒性研究显示,在所有受试动物种属均可见睾丸曲细精管萎缩,提示比卡鲁胺的抗雄激素效应。大鼠 6 个月和 12 个月重复给药毒性试验,在约为人用推荐剂量暴露量的 2 倍下出现睾丸萎缩。犬 12 个月重复给药毒性试验,在约为人用推荐剂量暴露量的 7 倍下出现睾丸萎缩。
雄性大鼠给予比卡鲁胺 250 mg/kg/天(约为人用推荐剂量暴露量的 2 倍),首次交配的交配间隔和交配成功时长增加,但交配成功后对生育力未见明显影响。给药 11 周后,这些作用经 7 周可恢复。
雌性大鼠给予比卡鲁胺 1、10、250 mg/kg/天(略低于人用推荐剂量暴露量的 2 倍),可增加发情周期不规律,但对生育力未见明显影响。
出生前后发育毒性试验中,大鼠给予比卡鲁胺 10 mg/kg/天(约为人用推荐剂量暴露量的 0.7 倍)及以上剂量,子代雌性大鼠的妊娠率减少。妊娠大鼠给予比卡鲁胺 10 mg/kg/天(约为人用推荐剂量暴露量的 0.7 倍)导致子代雄性大鼠雌性化,可见尿道下裂及阳痿。
胚胎-胎仔发育毒性试验中,妊娠大鼠在器官形成期(妊娠第 6~15 天)给予比卡鲁胺 10 mg/kg/天及以上剂量(约为人用推荐剂量暴露量的 0.7~2 倍),雄性胎仔出现肛殖距离缩短。
出生前后发育毒性试验中,雌性大鼠在妊娠第 7~16 天给药,并哺育子代至离乳。大鼠给予 10 mg/kg/天(约为人用推荐剂量暴露量的 0.7 倍)及以上剂量,雄性子代出现肛殖距离缩短。
在另一项出生前后发育毒性试验中,雌性大鼠在妊娠第 16 天至哺乳期 22 天给药,并继续哺育子代至离乳。亲代雌性大鼠在 250 mg/kg/天剂量下(约为人用推荐剂量暴露量的 2 倍),哺乳期同窝子代存活率和体重降低。大鼠给予 10 mg/kg/天(约为人用临床推荐剂量暴露量的 0.7 倍)及以上剂量,其雄性子代出现肛殖距离缩短、第二性器官较小、隐睾及尿道下裂,导致其交配能力和授孕能力降低,雌性子代妊娠率减少。
致癌性
在雌雄大鼠和小鼠两年致癌性试验,经口给予比卡鲁胺 5、15、75 mg/kg/天,出现多种肿瘤靶器官效应,这些肿瘤诱发与比卡鲁胺的抗雄激素作用有关。雄性大鼠在所有剂量水平下(5 mg/kg/天剂量下稳态血药浓度约为人用推荐剂量暴露量的 0.7 倍)出现睾丸良性间质细胞瘤,雌性大鼠在 75 mg/kg/天剂量下(约为人用推荐剂量暴露量的 1.5 倍)出现子宫腺癌。患者中尚未发现睾丸间质细胞增生,子宫肿瘤与目标患者群体无关。
雄性小鼠经口给予比卡鲁胺 75 mg/kg/天(约为人用推荐剂量暴露量的 4 倍),引起肝细胞癌发生率微增。大鼠经口给予比卡鲁胺 5 mg/kg/天(约为人用推荐剂量暴露量的 0.7 倍)及以上剂量,引起良性甲状腺滤泡细胞腺瘤发生率增加。这些肿瘤诱发与动物毒性试验中肝酶诱导的非肿瘤诱发进展的改变有关。在人体中,尚未发现比卡鲁胺具有酶诱导作用。未提示比卡鲁胺具有遗传毒性致癌作用。
【生产企业】
CORDEN PHARMA GMBH
信息来源:丁香园用药助手